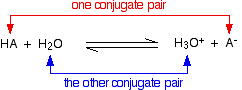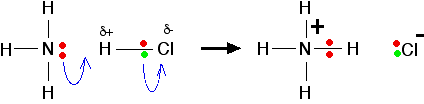Author: http://chemguide.co.uk/
|
TEORIAS DE ÁCIDOS E BASES Esta página descreve as teorias de ácidos e bases de Arrhenius, Bronsted-Lowry e Lewis e explica as relações entre eles. Também explica o conceito de um par conjugado - um ácido e sua base conjugada, ou uma base e seu ácido conjugado. | ||
|
Nota: Os currículos atuais do nível do Reino Unido A se concentram na teoria de Bronsted-Lowry, mas você também deve estar ciente de ácidos e bases de Lewis. A teoria de Arrhenius é de interesse histórico, e é improvável que você a precise, a menos que você esteja fazendo algum trabalho sobre o desenvolvimento de idéias em química. | ||
|
A Arrhenius Teoria dos ácidos e bases A teoria
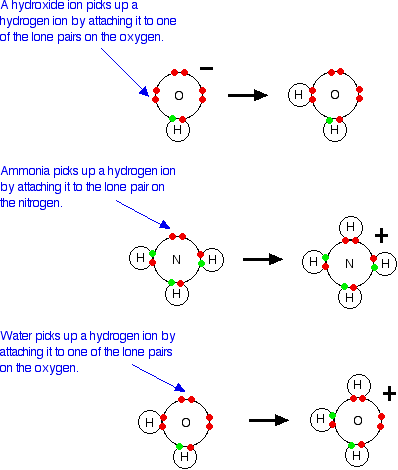
A neutralização ocorre porque os íons hidrogênio e íons hidróxido reagem para produzir água.
Limitações da teoria O ácido clorídrico é neutralizado por solução de hidróxido de sódio e solução de amônia. Em ambos os casos, você obtém uma solução incolor que você pode cristalizar para obter um sal branco - cloreto de sódio ou cloreto de amônio. Estas são claramente reações muito semelhantes. As equações completas são:
No caso de hidróxido de sódio, os íons de hidrogênio do ácido estão reagindo com íons hidróxido do hidróxido de sódio - em consonância com a teoria de Arrhenius. No entanto, no caso da amônia, não parece haver nenhum íon hidróxido! Mas se você olhar cuidadosamente as equações, a amônia está em solução - NH3(aq). A amônia reage com água assim:
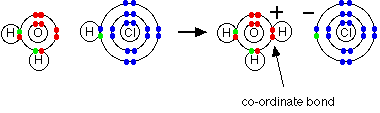
Esta é uma reação reversível, e em uma solução típica de amônia diluída, cerca de 99% da amônia permanece como moléculas de amônia. No entanto, há íons hidróxido lá e aqueles reagem com iões de hidrogênio da mesma maneira que os íons hidróxido de hidróxido de sódio. Então, você pode apenas justificar o amoníaco como base na definição de Arrhenius - ele produz íons hidróxido em solução. Mas a maior parte da reação será uma reação direta entre as moléculas de amônia e os íons de hidrogênio - o que não corresponde à definição de Arrhenius. Essa mesma reação ocorre também entre gás amônia e gás cloreto de hidrogênio.
Neste caso, não há hidrogênio ou íons hidróxido em solução - porque não há nenhuma solução. A teoria de Arrhenius não contaria isso como uma reação ácido-base, apesar de estar produzindo o mesmo produto que quando as duas substâncias estavam em solução. Isso é bobo! A Teoria Bronsted-Lowry de ácidos e bases A teoria
A relação entre a teoria de Bronsted-Lowry e a teoria de Arrhenius A teoria de Bronsted-Lowry não vai contra a teoria de Arrhenius de qualquer maneira - isso apenas aumenta. Os íons hidróxido ainda são bases porque aceitam íons de hidrogênio a partir de ácidos e formam água. Um ácido produz íons de hidrogênio em solução porque reage com as moléculas de água, dando um próton a eles. Quando o gás cloreto de hidrogénio se dissolve em água para produzir ácido clorídrico, a molécula de cloreto de hidrogênio dá um próton (um íon de hidrogênio) a uma molécula de água. Uma ligação covalente (covalente dativa) é formada entre um dos pares solitários no oxigênio e o hidrogênio do HCl. Íons de hidrogênio, H3O+, são produzidos.
| ||
|
Nota: Se você não tem certeza sobre Coordenar a ligação você deve seguir este link. Os laços de coordenação serão mencionados várias vezes ao longo do resto desta página. Use o botão BACK no seu navegador para retornar rapidamente a esta página. | ||
|
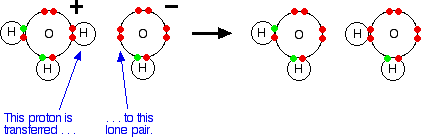
Quando um ácido em solução reage com uma base, o que realmente funciona como o ácido é o íon de hidroxônio. Por exemplo, um próton é transferido de um íon de hidroxônio para um íon hidróxido para produzir água.
Mostrando os elétrons, mas deixando para fora os internos:
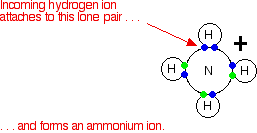
É importante perceber que sempre que você fala sobre iões de hidrogênio em solução, H+(aq), o que você realmente está falando são iões de hidroxónio. O cloreto de hidrogênio / problema de amônia Isso não é mais um problema usando a teoria de Bronsted-Lowry. Se você está falando sobre a reação em solução ou no estado do gás, a amônia é uma base porque aceita um próton (um íon de hidrogênio). O hidrogénio torna-se ligado ao par solitário no nitrogênio da amônia através de uma ligação coordenada.
Se estiver em solução, a amônia aceita um protão de um ião hidroxônio.:
Se a reação estiver acontecendo no estado do gás, a amônia aceita um protão diretamente do cloreto de hidrogênio:
De qualquer forma, a amônia atua como base aceitando um íon de hidrogênio de um ácido. Pares Conjugados Quando o cloreto de hidrogénio se dissolve em água, quase 100% reage com a água para produzir iões de hidroxónio e íons de cloreto. O cloreto de hidrogênio é um ácido forte e tendemos a escrever isso como uma reação unidirecional:
| ||
|
Nota: Estou deliberadamente faltando símbolos de estado nessa e a próxima equação para me concentrar nos bits que importam. Você encontrará mais sobre você encontrará mais sobre em outra página nesta seção. | ||
|
Na verdade, a reação entre HCl e água é reversível, mas apenas em uma extensão muito menor. A fim de generalizar, considere um HA ácido e pense que a reação é reversível.
Pensando sobre os reação direta:
Mas há também um reação de volta entre o íon hidronio e o A- ion:
A reação reversível contém dois acidos e duas bases. Pensamos neles em pares, chamado pares conjugados.
Quando o ácido, HA, perde um protão, ele forma uma base, A-. Quando a base, A-, aceita uma protão novamente, obviamente, reforma o ácido, HA. Estes dois são um par conjugado. Os membros de um par conjugado diferem um do outro pela presença ou ausência do íon de hidrogênio transferível. Se você está pensando sobre HA como o ácido, então A- É a base conjugada. Se você está pensando sobre A- como a base, então o HA é o ácido conjugado. A água e o ião hidroxônio são também um par conjugado. Pensando na água como base, o íon de hidroxônio é o ácido conjugado porque possui o íon de hidrogênio extra que pode dar novamente. Pensando no íon hidronio como um ácido, então a água é sua base conjugada. A água pode aceitar um íon de hidrogênio novamente para reformar o íon de hidronium. Um segundo exemplo de pares conjugados Esta é a reação entre amônia e água que olhamos anteriormente:
Pense primeiro sobre a reação direta. A amônia é uma base porque está aceitando íons de hidrogênio da água. O íon de amônio é seu ácido conjugado - pode libertar esse íon de hidrogênio novamente para reformar a amônia. A água está atuando como um ácido, e sua base conjugada é o íon hidróxido. O íon hidróxido pode aceitar um íon de hidrogênio para reformar a água. Olhando para ele do outro lado, o íon de amônio é um ácido e a amônia é a base conjugada. O íon hidróxido é uma base e a água é o ácido conjugado. Substâncias anfotéricas Você pode ter notado (embora provavelmente não!) Que em um dos dois últimos exemplos, a água estava atuando como base, enquanto que na outra estava atuando como um ácido. Uma substância que pode atuar como um ácido ou uma base é descrita como sendo anfoteric.
| ||
|
Nota: Você também pode se deparar com o termo anfiprotico neste contexto. As duas palavras estão relacionadas e facilmente confundidas. Um anfiprotico A substância é uma que pode doar íons de hidrogênio (prótons) e também aceitá-los. A água é um bom exemplo desse composto. A água atua como um ácido (doando íons de hidrogênio) e como base (aceitando-os). O "protico" parte da palavra refere-se aos íons de hidrogênio (prótons) sendo doados ou aceitos. Outros exemplos de compostos anfipróticos são aminoácidos e íons como HSO4- (que pode perder um íon de hidrogênio para formar íons de sulfato ou aceitar um para formar ácido sulfúrico). Mas, além de ser anfiprotico, esses compostos também são anfoteric. Anfoteric significa que eles têm reações como ácidos e bases. Então, qual é a diferença entre os dois termos? Todas as substâncias anfipróticas também são anfotéricas - mas o contrário não é verdadeiro. Existem substâncias anfotéricas que não doam ou aceitam íons de hidrogênio quando atuam como ácidos ou bases. Existe uma nova definição de comportamento ácido-base que você está prestes a atender (a teoria de Lewis) que não envolve necessariamente ions de hidrogênio. Um ácido de Lewis é um aceitador de pares de elétrons; Uma base de Lewis é um doador de pares de elétrons (veja abaixo). Alguns óxidos metálicos (como o óxido de alumínio) são anfotéricos - eles reagem tanto como ácidos como bases. Por exemplo, eles reagem como bases porque os íons óxidos aceitam íons de hidrogênio para produzir água. Isso não é um problema no que diz respeito à definição de amphiprotic - mas a reação como um ácido é. O óxido de alumínio não contém íons de hidrogênio para doar! Mas o óxido de alumínio reage com bases como a solução de hidróxido de sódio para formar iões de aluminatos complexos. Você pode pensar em pares solitários em íons hidróxido como formando laços covalentes dativos (coordenadas) com orbitais vazios nos iões de alumínio. Os íons de alumínio estão aceitando pares solitários (atuando como um ácido de Lewis). Portanto, o óxido de alumínio pode atuar tanto como ácido quanto como base - e também é anfotérico. Mas isso não é amphiprotic porque ambos da reação ácida e a reação de base não envolvem iões de hidrogênio. Eu passei por 40 anos de ensino (no laboratório, e através de livros e internet) sem usar o termo amphiprotic! Simplesmente não vejo isso. O termo anfotérico envolve todos os casos de substâncias funcionando como ácidos e bases sem exceção. O termo anfiprotico só pode ser usado onde ambas as funções envolvem a transferência de íons de hidrogênio - em outras palavras, ela só pode ser usada se você estiver limitado a falar sobre a teoria de Bronsted-Lowry. Pessoalmente, eu ficaria com o termo mais antigo, mais útil "anfoteric" a menos que seu programa exija que você use a palavra "anfiprotico". | ||
|
A Teoria Lewis dos ácidos e bases Esta teoria se estende muito além das coisas que você normalmente pensa como ácidos e bases. A Teoria
A relação entre a teoria de Lewis e a teoria de Bronsted-Lowry Bases de Lewis É mais fácil ver o relacionamento, observando exatamente o que as bases de Bronsted-Lowry fazem quando aceitam íons de hidrogênio. Três bases Bronsted-Lowry que examinamos são íons hidróxido, amônia e água, e são típicas de todo o resto.
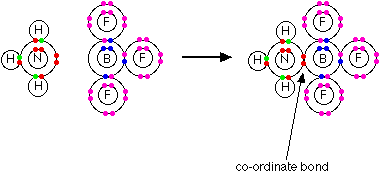
A teoria de Bronsted-Lowry diz que eles estão agindo como bases porque estão se combinando com iões de hidrogênio. A razão pela qual eles estão se combinando com iões de hidrogênio é que eles têm pares solitários de elétrons - o que a teoria de Lewis diz. Os dois são inteiramente consistentes. Então, como isso amplia o conceito de base? No momento, não - apenas olha para isso de um ângulo diferente. Mas e quanto a outras reações similares de amônia ou água, por exemplo? Sobre a teoria de Lewis, qualquer a reação em que a amônia ou a água usou seus pares solitários de elétrons para formar uma ligação coordenada seria contada como eles atuando como uma base. Aqui está uma reação que você encontrará sobre a página que trata da ligação coordenada. A amônia reage com BF3 usando seu par solitário para formar uma ligação coordenada com o orbital vazio no boro.
No que diz respeito à amônia, está se comportando exatamente como quando reage com um íon de hidrogênio - está usando seu par solitário para formar uma ligação coordenada. Se você vai descrevê-lo como uma base em um caso, faz sentido descrevê-lo como um no outro caso também. | ||
|
Nota: Se você ainda não leu a página sobre Coordenar a ligação você deve fazê-lo agora. Você encontrará um exemplo importante de água atuando como uma base de Lewis, bem como neste exemplo - embora o termo Base de Lewis não é usado nessa página. Use o botão BACK no seu navegador para retornar rapidamente a esta página. | ||
|
Ácidos de Lewis Os ácidos de Lewis são aceitadores de pares de elétrons. No exemplo acima, o BF3 está atuando como o ácido de Lewis ao aceitar o par solitário do nitrogênio. Na teoria de Bronsted-Lowry, a BF3 não tem nada remotamente ácido sobre isso. Esta é uma extensão do termo ácido muito além de uso comum. E sobre as reações obviamente acid-base - como, por exemplo, a reação entre amônia e gás cloreto de hidrogênio?
O que exatamente está aceitando o par solitário de elétrons no nitrogênio. Os livros de texto geralmente escrevem isso como se a amônia fosse doar seu par solitário para um íon de hidrogênio - um protão simples sem elétrons ao redor. Isso é enganador! Normalmente, você não obtém íons livres de hidrogênio em sistemas químicos. Eles são tão reativos que estão sempre ligados a outra coisa. Não há íons de hidrogênio não combinados em HCl. Não há um orbital vazio em qualquer lugar do HCl que possa aceitar um par de elétrons. Por que, então, é o HCl um ácido de Lewis? O cloro é mais eletronegativo do que o hidrogênio, o que significa que o cloreto de hidrogênio será uma molécula polar. Os elétrons na ligação hidrogênio-cloro serão atraídos para a extremidade do cloro, deixando o hidrogênio ligeiramente positivo e o cloro ligeiramente negativo .
| ||
|
Nota: Se você não tem certeza sobre electronegatividade e polaridade de ligação pode ser útil seguir este link. Use o botão BACK no seu navegador para retornar rapidamente a esta página. | ||
|
O par solitário no nitrogênio de uma molécula de amônia é atraído para o átomo de hidrogênio ligeiramente positivo no HCl. À medida que se aproxima, os elétrons na ligação hidrogênio-cloro são repelidos ainda mais para o cloro. Eventualmente, uma ligação coordenada é formada entre o nitrogênio e o hidrogênio, e o cloro desaparece como um ião cloreto. Isso é melhor mostrado usando o "seta encaracolada" notação comumente usada nos mecanismos de reação orgânica.
| ||
|
Nota: Se você não está feliz com o uso de setas encaracoladas para mostrar movimentos de pares de elétrons, você deve seguir esse link. Use o botão VOLTAR no seu navegador para retornar rapidamente a esta página. | ||
|
Toda a molécula de HCl está atuando como um ácido de Lewis. Está aceitando um par de elétrons da amônia, e no processo quebra. Os ácidos de Lewis não necessariamente têm que ter um orbital vazio existente. Um comentário final sobre ácidos e bases de Lewis Se você é um estudante do nível do Reino Unido, você pode ocasionalmente encontrar os termos Ácido de Lewis e Base de Lewis em livros didáticos ou outras fontes. Tudo o que você precisa lembrar é:
| ||
|
Nota: Lembre-se disso pensando que a amônia atua como base. A maioria das pessoas neste nível está familiarizado com o par solitário reativo nos íons de hidrogênio que aceitam nitrogênio. A amônia é básica por causa de seu par solitário. Isso significa que as bases devem ter pares solitários para doar. Os ácidos são o oposto. | ||
|
Para todos os propósitos gerais, fique com a teoria de Bronsted-Lowry. | ||
|
||